Parte 2. Técnicas para la toma y el procesamiento de muestras.
Como ya mencionamos en la primera parte de esta serie de posts, se puede sacar mucho partido al microscopio y ahorrar dinero al propietario, si parte de las pruebas incluidas en el diagnóstico, las podemos hacer nosotros mismos. Inicialmente, es conveniente contrastar nuestros resultados con los del laboratorio de referencia, pero según vayamos adquiriendo experiencia, podremos beneficiarnos, como decíamos con anterioridad, haciendo nosotros mismos las pruebas: en fin, resultados casi inmediatos que nos permiten instaurar el tratamiento en el momento, mayor margen de beneficio en las pruebas, resultados en cualquier horario (incluso en horario de urgencias), posibilidad de mostrar imágenes a los propietarios, etc.
Ya hicimos un repaso de los principales usos del microscopio y los pocos materiales necesarios, ahora vamos a centrarnos en la extracción de muestras y procesamiento según de qué prueba se trate.
MUESTRAS PARA CITOLOGÍA
IMPRONTA: Una impronta consiste en la realización de una impresión de la lesión directamente con el porta o mediante papel celo. Nos permite comprobar, por ejemplo, qué microorganismos están implicados en una infección superficial y valorar si es necesario realizar un cultivo.
HISOPADO: Esta técnica es muy útil para recoger muestras en zonas con pliegues, entre los dedos o en oídos. La clave para el éxito es realizar una presión muy suave al posicionar la muestra en el porta y extender bien la misma para que no sea demasiado gruesa. Los usos son similares a los de la impronta.
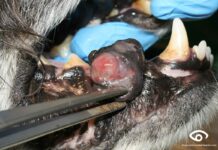
PAF o PAAF. La punción con aguja fina (PAF) y la punción-aspiración con aguja fina (PAAF) son las dos tècnicas de extracción de muestras más utilizadas en tumefacciones o tumores. Ante la duda, más vale puncionar que aspirar, en un primer intento. Debemos recordar que la contaminación con sangre dificulta la valoración correcta de la muestra, en caso de observar sangre se puede intentar volver a realizar la punción.
Los patólogos insisten mucho en :
Tomar múltiples muestras
No fragmentar las células de la muestra, evitando “escupir” la muestra del interior de la jeringuilla en el porta o hacer extensiones con una presión excesiva.
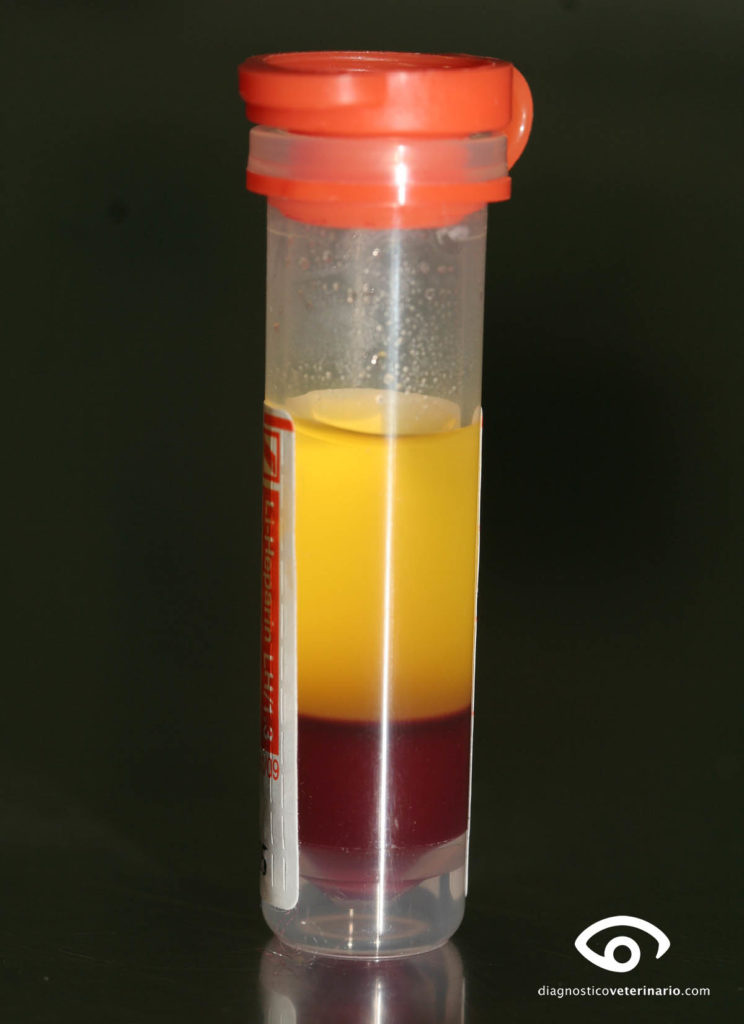
FROTIS: El frotis se suele realizar de una muestra de sangre. Es una prueba con una utilidad inmensa a la hora de valorar anemias (detección de macrocitosis e hipocromía, formas anormales como esquistocitos), comprobar si un resultado de trombocitopenia es real o artefactual (agregados), comprobar la presencia de neutrófilos en banda, indicativos de mal pronóstico, detección de células tumorales o formas parasitarias en sangre. Lo más crítico del frotis es realizar una buena extensión. Deberá ser continuada y tener forma de pluma. Es necesario practicar, pero vale la pena el tiempo invertido.
ANÁLISIS DE ORINA
Sedimento en observación directa: Los resultados de las tiras de orina pueden ser insuficientes, e incluso en ocasiones incorrectos, como en el caso de los falsos positivos a leucocitos en gatos. Por eso deben ser contrastados siempre con un sedimento y la comprobación de la densidad mediante refractrometría. No debemos olvidar que las muestras de orina no se deben refrigerar antes de analizar el sedimento, ya que pueden aparecer cristales que no estaban presentes inicialmente.
Sedimento teñido. Dejar secar el sedimento y teñirlo, nos puede permitir identificar células inflamatorias, bacterias e incluso células tumorales y se trata de una técnica poco realizada en la clínica, pero que puede aportar información muy útil.
ANÁLISIS DE HECES
Observación directa. Mirar una muestra de materia fecal de un cachorro con diarrea, obtenida al sacar el termómetro, puede darnos la clave para un tratamiento correcto y adecuado a su problema. Es posible identificar parásitos no habituales como giardias y coccidios que no responden al tratamiento habitual administrado a cachorros de manera preventiva.
Flotación de heces. Se trata de una prueba algo más elaborada que merece más espacio para explicar la técnica y el procedimiento. Lo ideal es solicitar tres muestras de días alternos (tres deposiciones distintas) refrigeradas. Este procedimiento permite aumentar la probabilidad de encontrar un parásito que se está excretando de manera intermitente. La flotación se puede realizar de las tres muestras de manera conjunta. Hay kits diseñados para realizar esta prueba, pero es posible elaborar uno en la clínica con solución saturada de sal, o de glucosa o en su defecto de almíbar. El objetivo es lograr una liquido de densidad elevada que favorezca la flotación de los huevos de parásitos y su adherencia a un cubreobjetos para poder ser visualizados en el microscopio.
La parte más complicada de la flotación (que se supera facilmente según avanza la curva de aprendizaje) es observar e identificar de manera adecuada los parásitos. Es común encontrar artefactos como material vegetal, esporas, gotas de grasa, etc. que no se deben confundir con parásitos.
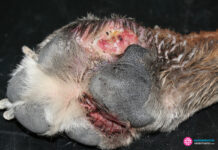
TRICOGRAMAS, RASPADOS y OTRAS MUESTRAS de observación directa. La obtención de muestra se puede realizar raspando con un bisturí hasta observar algo de sangre (ej, cuando la sospecha es Demodex spp) , en el caso de raspados, tirando de pelos tanto de la lesión como los bordes de la misma, u obteniendo descamación con unas pinzas o una cureta. Para observar la muestra bastará con poner una gota de parafina y/o lugol en el portaobjetos y taparla con un cubre, presionando ligeramente.
Para observar las muestras no teñidas como flotaciones de heces, sedimentos urinarios o tricogramas, debemos recordar cerrar el diafragma de nuestro microscopio. Ésto aumentará el contraste.

Una buena extensión deberá ser continuada y tener forma de pluma.

Lecturas recomendadas:
Carcinoma de células escamosas.
Disclaimer: El contenido de diagnosticoveterinario.com va dirigido a profesionales de la salud animal. No se resolverán consultas acerca de la salud de mascotas, les rogamos que si tienen dudas acerca de su mascota las dirijan a su veterinario de confianza. Los comentarios que no estén relacionados con la temática del post serán eliminados.