SARCOMA ASOCIADO AL PUNTO DE INYECCIÓN
Adrián Romairone Duarte / Juan Carlos Cartagena Albertus
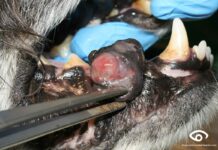
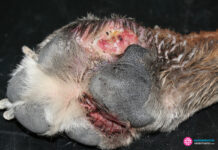
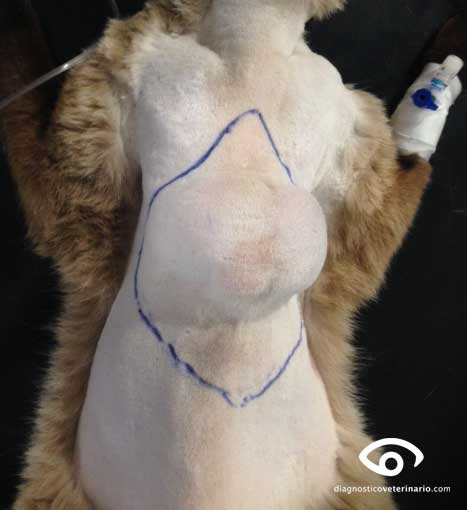
El sarcoma asociado al punto de inyección (SAPI) es un tumor agresivo, localmente invasivo, de origen mesenquimal que afecta al subcutáneo y al tejido muscular. Su apariencia es la de una masa firme, de superficie regular o irregular, y firmemente adherida a los tejidos circundantes.
Su alta tasa de recurrencia local posterior a la cirugía, debido a su escasa delimitación con los tejidos adyacentes (cápsula muy débil) lo convierte en un proceso tumoral que debe ser abordado en forma amplia y minuciosa desde el punto de vista diagnóstico y terapéutico.
Los datos estadísticos corroboran que, de cada 10.000 gatos vacunados, de 1 a 10 desarrollan esta neoplasia.
Aunque se ha descripto principalmente en el gato, también existen casos en otras especies, como es el caso del hurón (Munday, JS et al., 2003) y del perro, aunque con escasa representación (Vascellari, E et al., 2003).
ETIOLOGÍA
Factores predisponentes
GENÉTICA. La predisposición a padecer el sarcoma asociado al punto de inyección en líneas familiares podría sustentar la hipótesis de una predisposición genética (Hartmann, et al. 2015).
RAZA. No existe predisposición racial, y el SAPI afecta de igual manera a machos y a hembras.
EDAD. La edad de presentación tiene una frecuencia bimodal (entre los 6-7 años y los 10-11 años), a diferencia del fibrosarcoma, que generalmente aparece en gatos geriátricos. No obstante, la edad no es un factor excluyente ya que el SAPI puede aparecer a cualquier edad.
SOBREPESO. Entre los afectados, existe una mayor representación de animales con tendencia al sobrepeso, lo que ha hecho pensar que podría existir una relación entre la mayor infiltración en grasa y la aparición de este tipo de sarcomas.
VACUNAS Y ADYUVANTES. La presencia de adyuvantes en las vacunas no parece ser determinante en la aparición del SAPI, pero si la vacunación en si misma (rabia, leucemia felina, panleucopenia, calicivirus), con mucha probabilidad asociada a inflamación crónica.
RELACIÓN CON INYECTABLES
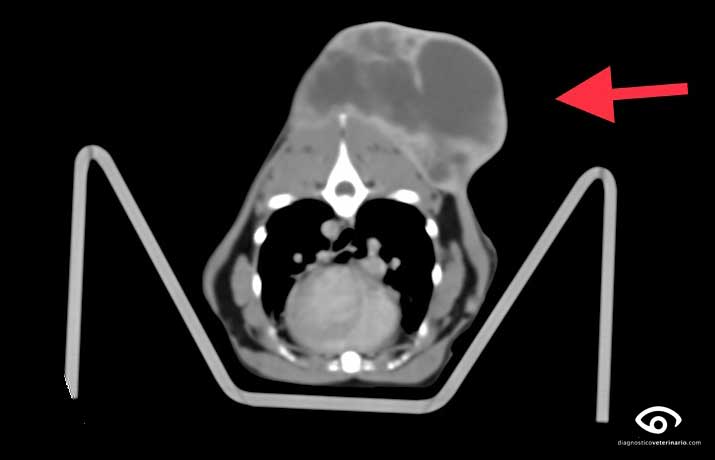
Como es sabido, los sarcomas asociados al punto de inyección se relacionan con las zonas habituales de vacunación e inyección de medicamentos en el gato. De hecho, la zona interescapular del gato ha sido motivo de estudio detallado utilizando técnicas de imagen como TAC y RM, lo que ha contribuido al conocimiento de la relación entre los musculos, la base ósea, las fascias y la aponeurosis de la zona, en distintas fases del movimiento. Esto ha hecho posible un mejor abordaje quirúrgico de los casos de SAPI y fibrosarcoma en el paciente felino (Longo et al., 2015).
Por su parte, Zardo et al. (2015) suman al TAC la utilización de la ecografía de cara al estudio y planificación quirúrgica, para establecer con mayor seguridad los márgenes quirúrgicos en esta neoplasia. Segun sus conclusiones, es necesario aumentar el número de estudios comparativos entre ambas formas de determinar los límites del tumor, ya que la ecografía parece no discriminar con exactitud los márgenes del tumor propiamente dicho y la respuesta inflamatoria del tejido circundante.
REGLA DEL 1-2-3 (según la VAFSTF – Vaccine Associated Feline Sarcoma Task Force), se debe sospechar de SAPI y realizar biopsia (incisional o excisional) de toda lesión que:
-
Aumente de tamaño 1 mes después de la inyección.
-
Crezca más de 2 centímetros.
-
Persista más de 3 meses después de la inyección.
PATOGENESIS
La respuesta inflamatoria crónica inducida por el agente inyectado produce granulomas inflamatorios que promueven la transformación neoplásica de los fibroblastos y miofibroblastos en pacientes genéticamente susceptibles (Hendrick, MJ, 1999).
El mecanismo de transición desde una inflamación crónica a un tejido tumoral no está muy bien definido todavía, pero diversos estudios involucran en él la sobreexpresión de factores de crecimiento que promueven la proliferación de fibroblastos, la angiogénesis y la activación de oncogenes.
Como en otros tipos de procesos tumorales, la mutación del gen supresor p53 también podría estar implicada en la génesis, desarrollo y progresión del SAPI.
El potencial metastasico de este tumor es bajo, pero su tendencia a invadir localmente es muy alta. Esta última característica está íntimamente ligada a la recurrencia posquirúrgica, cuando los márgenes quirúrgicos no son amplios y el grado de infiltración es muy grande (a más tiempo, más tamaño, más infiltración.
Un enfoque multimodal del tratamiento que incluya cirugía, quimioterapia y radioterapia asegura mejores resultados a largo plazo, que hacerlos por separado.
METÁSTASIS. La metástasis pulmonar es la que se describe con mayor frecuencia (10 a 24 % de los casos), seguida en orden de importancia por la diseminación metastásica a ganglios linfaticos regionales, piel, bazo y, por último, la afectación generalizada o multiorgánica.
El tumor se origina a partir de la malignización de fibroblastos y miofibroblastos, previamente activados (reactivos) por la inflamación crónica inducida en el sitio de inyección.

LECTURAS RECOMENDADAS
Cronin K.; Page R.L.; Spodnick G.; Dodge R.; Hardie E.N.; Price G.S., et al. Radiation therapy and surgery for fibrosarcoma in 33 cats. Vet. Radiol Ultrasound. 39:51- 56 (1998).
Hartmann K.; Day M.J.; Thiry E.; Lloret A., Frymus T., et al. Feline Injection site sarcoma. ABCD guidelines on prevention and management. Journal of Feline Medici- ne and Surgery (2015) 17, 606-613.
Hendrick M.J. Feline vaccine-associated sarcomas. Can- cer investigation. 17:273-277 (1999).
Holtermann N., Kiupel M., Hirschberger J. The tyro- sine kinase inhibitor toceranib in feline injection site sarcoma: efficacy and side effects. Veterinary and Comparative Oncology. DOI: 10.1111/vco.12207 (2016).
Longo M., Modina S., Bellotti A., Di Giancamillo M. Ad- vances in the anatomic study of the interscapular region of the cat. BMC, Veterinary Research 11:249 (2015). DOI 10.1 186/s12917-015-0562-y
Munday J.S.; Stedman N.L.; Richey L.J. Histology and immunohistochemistry of seven ferret vaccination-site fibrosarcomas. Vet Patholo 40:288-293 (2003). Porcellato I., Menchetti C., Brachelente C., Sforma M., Reginato A., Lepri E., Mechelli L. Feline Injection-site sarcoma: Matrix remodeling and prognosis. Veterinary Pathology. Vol 54 (2) 204-211 (2017).
Phelps H.A., Kuntz C.A., Milner R.J., Powers B.E., Ba- con N.J. Radical excision with five-centimeter margins for treatment of feline injection-site sarcomas: 91 cases (1998-2002). JAVMA, vol 239, N.o 1; July 1 (2011). Romanelli G., Marconato L., Olivero D., Massari F., et al. Analysis of prognostic factors associated with injection- site sarcomas in cats: 57 cases (2001-2007). J Vet Am. Med Assoc. V 232. P 1193-1199 (2008).
Saba C.F., Vail D.M., Thamm D.H. Phase II clinical eva- luation of lomustine chemoterapy for feline vaccine- associated sarcoma. Veterinary and Comparative Onco- logy. 10 (4):283-291 (2011).
Vascellari E., Melchiotti E., Bozza M.A., Mutinelli F. Fi- brosarcomas at presumed sites of injection in dogs: cha- racteristics and comparison with non vaccination site fibrosarcomas and feline post vaccinal fibrosarcomas. J. Vet. Med A 50: 286-291 (2003).
Zabielska-Koczywas K., Woktalewicz A., Lechowski R. Current knowledge on feline injection-site sarcoma treatment. Acta Veterinaria Scandinavica, 59:47 (2017). DOI 10.1186/s13028-017-0315-y.
Zardo K.M., Petri Damiani L., Matera J.M., Brandao de Campos A.C. Recurrent and non-recurrent feline injec- tion site sarcoma: computed tomographic and ultra- sonographic findings. Journal of Feline Medicine and Surgery 1_10. (2015).